週1回投与のGLP-1受容体作動薬オゼンピック®(セマグルチド)が製造販売承認を取得しました
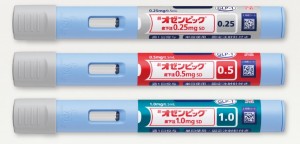
2型糖尿病を適応症とする週1回投与のGLP-1受容体作動薬「オゼンピック®皮下注0.25mg SD」、「オゼンピック®皮下注0.5mg SD」、「オゼンピック®皮下注1.0mg SD」(以下、オゼンピック®皮下注SD)が、2020年3月12日にわが国で製造販売承認を取得しました。
セマグルチドは、大規模臨床試験SUSTAIN-6にて心血管リスクを低減する可能性が示されるとともに、腎症の新規発生および悪化を抑制することも示された薬剤であり(DONATS 2016/10/21に掲載)、また、同試験において、0.5mg:-3.6kg、1.0mg:-4.9kgと著明な体重減少も示しており、その効果とエビデンスの面から期待される薬剤です。本剤は2018年3月に2mg製剤の承認を取得(DONATS 2018/3/26に掲載)しましたが、その後、14日投与日数制限に完全に対応できないとして薬価収載希望を取り下げた経緯があります。
今回新たに承認されたオゼンピック®皮下注SDは、注射針があらかじめ装着されており、注射針の取り付けや取り外しの必要がなく、皮膚に押し当てるだけで、自動的に注入が開始できるオートインジェクションの機能を備えた注入器を用いた製剤です。製品名に含まれる「SD」は単回投与を意味する「Single Dose」の頭文字に由来します。
なお、現時点では薬価収載時期は未定です。
(情報元:ノボノルディスクファーマ株式会社プレスリリース(2020.3.13))